Por anos, as patentes farmacêuticas têm sido apresentadas como um dos pilares da inovação em saúde. Sem elas, argumentam as indústrias, não haveria incentivo para investir bilhões em pesquisas que podem levar mais de uma década até se transformar em um medicamento aprovado. Por outro lado, os críticos alertam que monopólios excessivamente longos aumentam o custo dos tratamentos e limitam o acesso em países em desenvolvimento. Hoje, com as novas fronteiras da biotecnologia e o uso crescente da inteligência artificial na descoberta de moléculas, a discussão ganha ainda mais relevância.
Ricardo Remer, sócio-fundador da Remer Villaça & Nogueira e da Remer Consultores, é categórico ao lembrar que o debate vai além da técnica:
“Sequências biológicas não naturais são patenteáveis. No Brasil, métodos de tratamento não são. O auxílio da inteligência artificial não afeta a patenteabilidade. Mas uma invenção feita inteiramente por IA pode enfrentar restrições — porque o sistema jurídico exige inventores humanos”.
“Quebra de patente” ou licença compulsória: o que a lei realmente permite
No Brasil, e em boa parte do mundo, o termo “quebra de patente” é amplamente usado, mas tecnicamente equivocado. O instrumento jurídico correto é a licença compulsória, prevista tanto no acordo TRIPS (da Organização Mundial do Comércio) quanto na Lei de Propriedade Industrial (LPI). Trata-se da autorização para uso de uma tecnologia sem a anuência do titular, mas com o pagamento de remuneração.
Esse mecanismo ganhou novo fôlego em 2021, com a aprovação da Lei 14.200, que ampliou as hipóteses de concessão em casos de emergência nacional ou interesse público. Foi exatamente esse raciocínio que o Brasil aplicou em 2007, ao decretar a licença compulsória do antirretroviral efavirenz (Decreto 6.108/2007), fundamental para o programa de combate à AIDS. A medida gerou uma economia de cerca de R$ 30 milhões anuais ao Ministério da Saúde e se tornou um marco internacional de política pública.
Outros países recorreram ao mecanismo com mais frequência: a Tailândia emitiu licenças para antirretrovirais em meados dos anos 2000, e a Índia, em 2012, concedeu sua primeira licença ao sorafenibe. A OMS aponta que o uso desse instrumento foi crucial para ampliar o acesso a medicamentos de HIV e hepatite C em países de baixa renda.
Remer ressalta que a licença compulsória é muitas vezes demonizada, mas na prática é um instrumento legítimo:
“O debate ético se desloca mais para o uso da propriedade do que para a sua existência em si. O binômio esforço-investimento precisa ser respeitado, mas sempre em diálogo com o direito fundamental à saúde”.
O fim da proteção mínima de 10 anos e o novo cenário da concorrência
Outro divisor de águas veio em 2021, quando o Supremo Tribunal Federal (STF) julgou a ADI 5529 e derrubou o parágrafo único do artigo 40 da LPI, que garantia um prazo mínimo de dez anos de vigência a qualquer patente. Na prática, esse dispositivo prolongava monopólios farmacêuticos em função da demora do INPI para examinar pedidos. O STF não apenas invalidou a regra, como modulou os efeitos retroativamente para fármacos e dispositivos médicos — decisão considerada histórica para abrir espaço à concorrência e reduzir preços.
De acordo com estimativas do IESS (Instituto de Estudos de Saúde Suplementar), a decisão pode reduzir em até 15% os preços médios de determinados medicamentos de referência. Essa mudança também acelerou a entrada de genéricos e biossimilares, segmento que movimentou cerca de R$ 2,5 bilhões no Brasil em 2023, representando alívio financeiro para planos de saúde e para o SUS.
“Um conjunto de desafios técnicos pode originar diferentes patentes, cada uma com 20 anos contados de datas distintas. Isso é acúmulo de mérito, e não se confunde com evergreening — prática indesejável quando há uso indevido do sistema para prorrogar monopólios”, observa Remer.
Florestas de patentes, trolls e os limites do sistema
Pesquisas recentes da ONG I-MAK apontam que os 10 medicamentos mais vendidos nos Estados Unidos acumulam, em média, 74 patentes cada, criando verdadeiras “muralhas” contra a concorrência. Esse fenômeno é chamado de patent thicket. O instituto calcula que tal excesso adiciona até US$ 52 bilhões em custos para os consumidores.
Um exemplo emblemático é o Humira (adalimumabe), da AbbVie, que chegou a registrar mais de 100 patentes nos EUA e conseguiu retardar a entrada de biossimilares por quase 20 anos, mantendo preços altíssimos para tratamentos de artrite reumatoide e doenças inflamatórias.
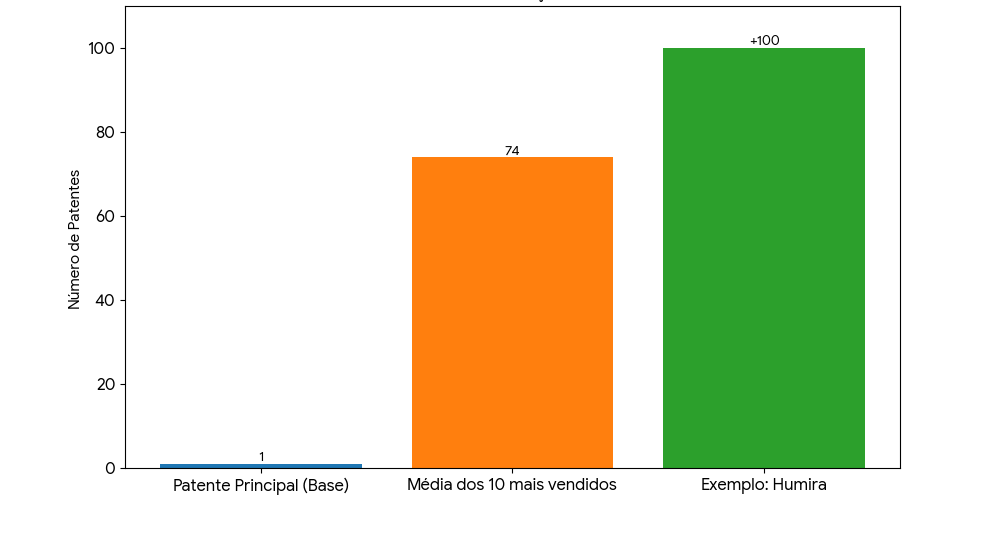
O tema não é consensual. O Hudson Institute e até o próprio USPTO contestaram a metodologia da I-MAK, alegando que nem todas as patentes adicionais são relevantes ou efetivamente bloqueiam a concorrência.
Remer pondera que a fronteira entre inovação legítima e abuso é tênue:
“Às vezes há abuso mesmo com apenas uma patente. Outras vezes, múltiplas patentes refletem um acúmulo legítimo de soluções técnicas. O ponto central é a forma de uso — se é para inovar ou para sufocar a concorrência”.
O problema se agrava com os chamados patent trolls — empresas que não produzem medicamentos, mas vivem de litígios, processando concorrentes em busca de indenizações milionárias. No setor farmacêutico, onde o tempo de mercado é crítico, essa prática pode atrasar a entrada de genéricos e impactar diretamente os gastos públicos em saúde.
TRIPS, Doha e as respostas internacionais à saúde pública
A Declaração de Doha (2001) reafirmou que o TRIPS deve ser interpretado de forma a proteger a saúde pública, e não apenas os interesses comerciais. Essa posição abriu caminho para países utilizarem a licença compulsória em larga escala. Um exemplo foi a Tailândia, que em meados dos anos 2000 emitiu licenças para o efavirenz e o lopinavir/ritonavir. Outro caso foi o Canadá, que exportou medicamentos a Ruanda sob o artigo 31bis do TRIPS, um dispositivo criado para países sem capacidade de produção própria.
Além disso, a África do Sul se tornou símbolo dessa luta ao enfrentar, em 2001, um processo movido por 39 farmacêuticas quando tentou importar genéricos para HIV. Após intensa pressão internacional, as empresas desistiram da ação, consolidando o entendimento de que a saúde pública deveria prevalecer sobre interesses comerciais.
Durante a pandemia, o tema voltou à mesa da OMC. Em 2022, foi aprovado um waiver temporário para suspender patentes de vacinas contra a COVID-19. A discussão sobre estender o mecanismo a terapias e diagnósticos dividiu países ricos e em desenvolvimento, evidenciando a atualidade da questão.
Exclusividade regulatória: uma barreira invisível
Além das patentes, há também regimes de exclusividade regulatória. Nos EUA, a lei Hatch-Waxman garante 5 anos de exclusividade para novas entidades químicas, 3 anos para estudos adicionais e 7 anos para medicamentos órfãos. Na União Europeia, o modelo “8+2+1” e os SPCs (certificados complementares de proteção) podem estender prazos em até cinco anos.
Esses mecanismos podem adiar a concorrência mesmo após o vencimento da patente. Nos EUA, terapias órfãs chegam a custar centenas de milhares de dólares por paciente ao ano, justamente porque a exclusividade regulatória impediu a entrada de competidores.
No Brasil, não existe um sistema equivalente de proteção de dados clínicos, o que significa que o país depende mais das patentes do que de outros instrumentos regulatórios para equilibrar inovação e acesso. Esse ponto, pouco discutido no debate público, ajuda a explicar as diferenças de dinâmica de mercado entre os países — e é alvo de pressões internacionais para mudança.
O tarifaço de Trump e a pressão sobre o SUS
Se os dilemas já eram complexos, em 2025 uma variável externa os tornou ainda mais urgentes: o tarifaço imposto por Donald Trump sobre medicamentos importados. Segundo especialistas, a medida pode aumentar significativamente os custos de abastecimento do Brasil e de outros países dependentes de importação.
De acordo com a Interfarma, cerca de 85% dos princípios ativos usados pela indústria brasileira vêm do exterior, sobretudo da China e da Índia. Um aumento tarifário de 20% — patamar já projetado para alguns insumos — pode gerar bilhões de reais em custos adicionais para o SUS, especialmente em tratamentos de câncer e doenças autoimunes, que já figuram entre os maiores gastos da saúde pública.
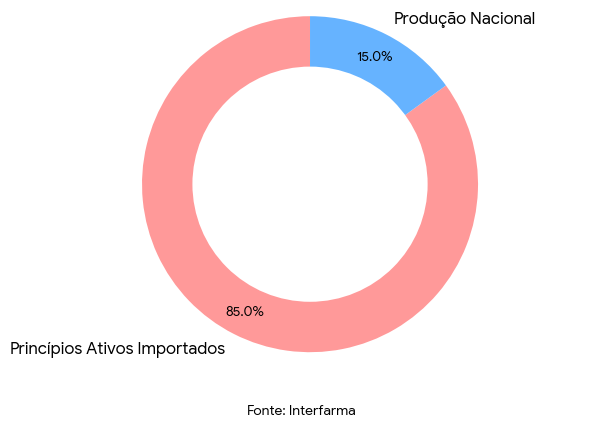
Reportagens recentes do Brasil de Fato e do Valor Econômico apontam que o Brasil pode ser forçado a recorrer novamente à licença compulsória para proteger o SUS. A medida já é defendida por entidades de saúde pública como forma de garantir acesso a tratamentos de alto custo em meio à instabilidade do comércio internacional.
Remer ressalta o equilíbrio necessário nesse contexto:
“A questão dos custos de medicamentos é complexa: tanto o abuso de trolls quanto a ausência total de proteção trazem prejuízos ao acesso. Sem patentes, não há incentivo econômico suficiente para produção. Mas sem equilíbrio, o preço se torna insustentável para os sistemas de saúde”.
Entre inovação e acesso
Os casos da Índia são ilustrativos: em 2012, o país concedeu sua primeira licença compulsória ao sorafenibe (Nexavar), alegando preços abusivos. Já em 2013, negou à Novartis a patente do Glivec, entendendo que se tratava de evergreening, sem ganho terapêutico real — decisão que ecoa até hoje em fóruns de saúde pública.
No Brasil, decisões como a do STF em 2021, que retroagiu o fim do “prazo mínimo de 10 anos”, mostram que o Judiciário também tem papel ativo em moldar o equilíbrio entre inovação e acesso.
“O acesso é possibilitado, em primeiro lugar, por quem desbravou o desconhecido e trouxe um novo benefício à sociedade. Sem propriedade intelectual, start-ups e pequenas empresas de biotecnologia dificilmente sobreviveriam até completar o longo caminho da inovação”, reforça Remer.
O dilema se reflete na geopolítica da saúde: enquanto a Índia se consolida como líder mundial em genéricos, os EUA continuam sendo o epicentro dos investimentos em biotecnologia, com mais de US$ 25 bilhões aportados em 2023. Na América Latina, países como México e Colômbia discutem ajustes em suas legislações para garantir acesso mais rápido a genéricos, em linha com os avanços regulatórios já feitos no Brasil.
A Green Rock é uma gestora de investimentos independente, focada em negócios de Venture Capital e Private Equity de alto potencial no setor da saúde do Brasil e toda a América Latina.


.png)


